per Júlia Viladevall Sánchez
El sistema immunitari és l’encarregat de protegir el nostre cos davant les possibles amenaces de l’exterior. Una maquinària ben coordinada s’ocupa d’identificar i eliminar tots els elements que no reconeix com a propis. Com bé explicava en Víctor en aquest article, aquests mecanismes de vigilància s’activen quan detecten la presència de cèl·lules canceroses.
Tot i haver-se generat a partir de cèl·lules del nostre organisme, les cèl·lules tumorals presenten nombroses alteracions genètiques que fan que les proteïnes de superfície (antígens) s’alterin de tal manera que ja no són reconegudes com a pròpies. L’exposició i reconeixement dels antígens de membrana de les cèl·lules tumorals desencadena una resposta que permet a les cèl·lules immunes poder-les matar. Sovint, però, els tumors desenvolupen estratègies per camuflar-se i evadir la resposta immunitària.
Les immunoteràpies van néixer amb la idea d’aprofitar mecanismes propis del nostre organisme per guiar i fomentar una resposta de defensa davant les cèl·lules canceroses. Podríem dir que busquen reactivar la resposta immunitària natural que el tumor ha aconseguit evadir.
Avui en dia, els tractaments pel càncer continuen basant-se àmpliament en la cirurgia, la quimioteràpia i la radioteràpia. L’aparició cada vegada més primerenca dels càncers i l’altíssima prevalença en societats occidentals han impulsat la necessitat de buscar tractaments més específics i menys tòxics.
Tractaments fets a mida
Fa prop de 25 anys, l’aparició de les teràpies dirigides va capgirar el paradigma del tractament del càncer per a molts pacients. L’estudi detallat dels canvis moleculars específics de les cèl·lules canceroses van permetre dissenyar fàrmacs dirigits capaços d’inhibir-los de manera específica, amb efectes secundaris sistèmics més reduïts.

En l’última dècada, els científics han treballat amb la idea d’utilitzar mecanismes naturals del nostre cos per atacar les cèl·lules canceroses, com és el cas de la resposta immunitària. El descobriment de les immunoteràpies ha tingut gran rellevància, fins al punt que avui en dia s’utilitzen com a complement o fins i tot com a tractament de primera línia en diferents tipus de càncers, incloent-hi el melanoma, el càncer de ronyó o bufeta i el càncer de mama.
Una de les estratègies d’immunoteràpia utilitzades avui en dia consisteix a entrenar les cèl·lules del mateix pacient perquè siguin capaces de reconèixer i atacar les cèl·lules canceroses de manera autònoma. La teràpia de limfòcits T amb receptors d’antígens quimèrics, o CAR-T per les seves sigles en anglès, és una immunoteràpia d’aquest tipus.
Cap de lleó, cos de cabra i cua de drac
En la mitologia grega, una quimera és un monstre amb el cap de lleó, el cos de cabra i la cua de drac. La bioquímica fa servir l’adjectiu “quimèric” per descriure aquelles proteïnes que han estat creades a partir de la traducció de dos o més gens independents que s’han unit naturalment o de manera artificial. Les proteïnes resultants s’anomenen proteïnes quimèriques o proteïnes de fusió. La funció d’aquesta nova proteïna és sovint una sinergia entre les funcions que tindrien per separat les parts que la integren.
Els limfòcits T són un tipus de glòbuls blancs que duen a terme funcions com la regulació de la resposta immunitària i l’atac i destrucció de cèl·lules infectades. La teràpia CAR-T es basa en l’obtenció i modificació in vitro dels limfòcits T del pacient per fer-los capaços de reconèixer i eliminar cèl·lules canceroses. La modificació genètica dels limfòcits T al laboratori els prepara per expressar un tipus de proteïna de fusió a les seves membranes: els receptors d’antígens quimèrics. Aquests receptors els permeten detectar de manera específica els antígens de membrana de les cèl·lules tumorals. La resposta immune orquestrada pels limfòcits T modificats permet matar de manera molt dirigida les cèl·lules canceroses.
Un cop modificats, aquests limfòcits T es multipliquen de manera exponencial al laboratori abans de tornar-los a transfondre al pacient, on circularan pel torrent sanguini duent a terme les seves tasques de reconeixement i eliminació.
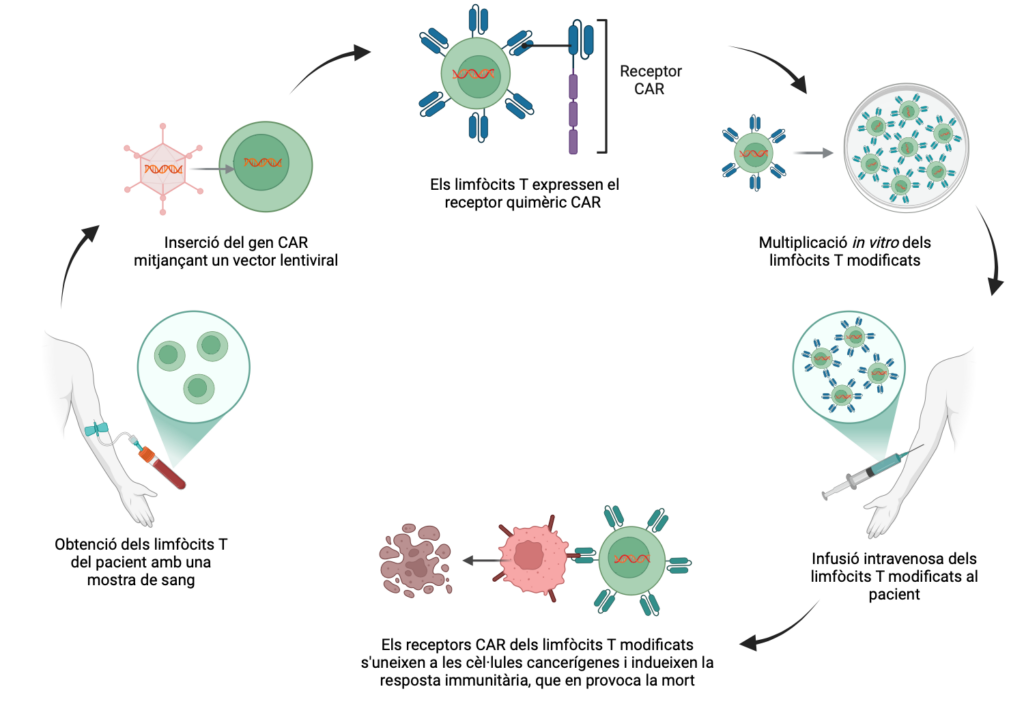
Armes de precisió
Una de les claus de la teràpia CAR-T és l’especificitat. A diferència de la quimioteràpia o la radioteràpia, està dissenyada per distingir les cèl·lules sanes de les cèl·lules tumorals i, eliminar de manera molt específica aquestes últimes. Tot i això, hem de tenir en compte que al parlar de cèl·lules tumorals o canceroses ens estem referint a un grup extremadament heterogeni. El càncer és un conjunt de malalties divers i complex que tenen una cosa en comú: una proliferació descontrolada de cèl·lules en un o múltiples òrgans del cos. Cada tipus de càncer es caracteritza per la proliferació d’un tipus cel·lular en concret. Per aquesta raó, el disseny d’una teràpia CAR-T es fa per un únic tipus cel·lular concret.
Quan els limfòcits CAR-T localitzen les cèl·lules canceroses recluten altres tipus de glòbuls blancs que els ajudaran a poder-les destruir. La mobilització de grans quantitats de glòbuls blancs durant la resposta immunitària provoca l’alliberament d’unes molècules anomenades citocines. Les citocines són petites proteïnes que les cèl·lules fan servir per comunicar-se entre elles i, entre d’altres, coordinar la resposta immunitària.
Una complicació freqüent del tractament amb CAR-T és l’anomenada síndrome d’alliberament de citocines, que passa quan els glòbuls blancs produeixen més citocines del compte i aquestes retroalimenten altres glòbuls blancs perquè en produeixin encara més. L’alliberació descontrolada de citocines pot afectar diversos òrgans i inflamar-los. Un exemple és el cervell, on les altes concentracions de citocines poden provocar neurotoxicitat.
Ampliar els objectius
Per totes les raons que hem explicat, actualment el tractament amb CAR-T no és una teràpia d’elecció per cap càncer, sinó que es reserva per casos en què els pacients no reaccionen al tractament o han patit una recaiguda. L’objectiu de la comunitat científica és reduir-ne la toxicitat i millorar-ne les taxes d’èxit per poder administrar-lo a un grup més ampli de pacients en el futur.
Així mateix, avui dia només s’ha aconseguit desenvolupar teràpies CAR-T per càncers hematològics, com la leucèmia, el limfoma i el mieloma. La raó és fàcil d’explicar. En aquests tipus de càncers les cèl·lules canceroses es troben circulant al sistema sanguini o limfàtic. Els tumors sòlids, en canvi, compten amb un microambient que els protegeix i sovint dificulta l’entrada dels limfòcits T mitjançant els mecanismes d’evasió de la resposta immunitària. Encara que no hi ha cap teràpia CAR-T disponible per tumors sòlids al mercat, hi ha molts grups de recerca treballant en el seu desenvolupament.
La teràpia CAR-T a Catalunya
El primer assaig clínic de CAR-T a Catalunya, i al conjunt d’Espanya, es va realitzar amb pacients pediàtrics a l’Hospital Sant Joan de Déu de Barcelona l’any 2016. Els resultats van ser espectaculars, amb un 80% dels pacients lliures de malaltia un any després del tractament amb CAR-T. Els pacients que van participar en l’assaig havien esgotat totes les opcions terapèutiques existents, incloent-hi el trasplantament de progenitors hematopoètics.
Lògicament, l’arribada de la teràpia CAR-T va canviar radicalment el pronòstic d’aquells pacients i de molts altres. En aquell moment, la majoria de noves teràpies CAR-T eren desenvolupades per grans indústries farmacèutiques. Els assajos clínics tenien un cost molt elevat i això dificultava que els pacients hi poguessin accedir.
Paral·lelament, es va iniciar la creació d’una nova generació de teràpies CAR-T “acadèmiques”, desenvolupades directament pels hospitals públics. L’Hospital Clínic de Barcelona ha estat pioner en aquest camp. Actualment, dues teràpies CAR-T desenvolupades per l’Hospital Clínic han estat aprovades com a medicaments de teràpia avançada de fabricació no industrial per part de l’Agència Espanyola del Medicament i Productes Sanitaris (AEMPS). El CAR-T ARI-0002h pel mieloma múltiple en adults, desenvolupat per l’Hospital Clínic, va ser aprovat l’any 2024 després d’aconseguir un 95% de resposta al tractament per part dels participants en l’estudi.
Ja per acabar…
Fa prop de 25 anys l’aparició de les primeres teràpies personalitzades va capgirar el paradigma del tractament del càncer per a molts pacients. Durant aquests anys, desenes de teràpies s’han anat sumant a la llista de tractaments disponibles, sovint per pacients que ja havien esgotat totes les altres opcions. En l’última dècada, la immunoteràpia amb CAR-T ha guanyat importància en el tractament de càncers hematològics, com la leucèmia, el limfoma i el mieloma. La comunitat científica continua treballant per desenvolupar CAR-T per altres càncers hematològics i per aconseguir adaptar-los per tractar tumors sòlids.
Curiositat: Els CAR-T de l’Hospital Clínic porten el nom “ARI” per reconèixer el paper clau del projecte ARI en la recerca d’aquestes teràpies. L’Ariana Benedé va ser una pacient del Clínic amb leucèmia limfoblàstica aguda que va morir l’any 2016 després d’esgotar totes les opcions de tractament. Durant la seva malaltia va ser coneixedora de l’existència de les teràpies CAR-T als Estats Units i a través del projecte ARI va voler fer-les arribar a Catalunya. La seva idea, i els diners recaptats amb la seva iniciativa, van constituir l’embrió de la recerca en teràpies CAR-T a l’Hospital Clínic.
Per saber-ne més
National Cancer Institute – CAR T Cells: Engineering Patients’ Immune Cells to Treat Their Cancers
Fundació Josep Carreras contra la Leucèmia – Inmunoterapia CART o como rediseñar las propias células para atacar al cáncer
CAR-T cell immunotherapy for human cancer – Carl H. June et al. 2018 (DOI:10.1126/science.aar6711)
Sobre l’autora: Júlia Viladevall Sánchez
Graduada en Ciències Biomèdiques (UB) i del màster en Biologia de les Cèl·lules Mare (Universitat de Cambridge). Actualment soc estudiant de doctorat en Hematologia a la Universitat de Cambridge, on investigo el comportament de les cèl·lules mare de la sang durant el desenvolupament embrionari. Crec fermament en la importància d’apropar la ciència a la societat i de fomentar les vocacions científiques en infants i joves. Per això sempre que puc aporto el meu granet de sorra a la divulgació científica en català.

Imatges:
Imatge de portada – Wikimedia commons amb llicència Creative Commons Attribution-Sharealike 4.0 International; 2.Imatge generada amb Biorender.com
Refèrencies:
- June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S., & Milone, M. C. (2018). CAR T cell immunotherapy for human cancer. Science, 359(6382), 1361–1365. https://doi.org/10.1126/science.aar6711
- Zhu, S. (2024). CAR-T in cancer therapeutics and updates. Journal of the National Cancer Center, 4(3), 189-194. https://doi.org/10.1016/j.jncc.2024.01.001
- Fundació Josep Carreras contra la Leucèmia. (2022). Inmunoterapia CAR-T. Recuperat de https://fcarreras.org/blog/inmunoterapiacart/
- World Health Organization. (2022). Cancer. Recuperat de https://www.who.int/news-room/fact-sheets/detail/cancer
- National Cancer Institute. (2022). CAR T-cell therapy for cancer: What to know. Recuperat de https://www.cancer.gov/about-cancer/treatment/research/car-t-cells
- Clínic Barcelona. (2024). Llum verda al CAR-T ARI0002h desenvolupat pel Clínic-IDIBAPS per a pacients amb mieloma múltiple. Recuperat de https://www.clinicbarcelona.org/ca/noticies/llum-verda-al-car-t-ari0002h-desenvolupat-pel-clinic-idibaps-per-a-pacients-amb-mieloma-multiple
- Clínic Barcelona. (2024). Noves estratègies per millorar l’eficàcia de la teràpia CAR-T en tumors sòlids. Recuperat de https://www.clinicbarcelona.org/ca/noticies/noves-estrategies-per-millorar-leficacia-de-la-terapia-car-t-en-tumors-solids
Revisors: Nil Salvat Rovira, Mar Barrantes Cepas i Víctor Naharro Oriol






Gràcies per “continuar” amb la feina d’apropar la ciència a tothom.
Quines notícies més bones aquests avenços. Gràcies a les persones que ho feu possible! 🫶