Des que els humans vam establir-nos en assentaments permanents al Neolític, que hem estat aprenent a domesticar els animals i les plantes. Per fer-ho, seleccionàvem aquells animals que ens agradaven més per una característica o una altra. Així vam aconseguir domesticar els muflons per acabar obtenint les ovelles d’avui dia.

Sense ser-ne ben bé conscients els nostres avantpassats han estat jugant amb el DNA de diferents espècies -encara que indirectament a partir d’escollir fenotips-. Un bon exemple és el gran nombre de races de gossos que tots coneixem.
Els orígens de la genètica
Durant tots aquests segles no hem estat capaços d’entendre com s’heretaven els caràcters. Si una dona amb ulls verds i un home amb ulls marrons tenen una filla, tindrà els ulls verds, marrons o una mescla? I en quina probabilitat? La creença era que sempre es barrejaven les “sangs” i s’obtenien unes característiques intermèdies.
No va ser fins a començament del segle XX que Morgan va redescobrir les lleis de l’herència descobertes per Gregor Mendel. Mendel va ser un monjo agustí i naturalista que va desxifrar com es transmetien els caràcters mendelians en pèsols -exemples de caràcters en humans: color del cabell, forma del nas, grup sanguini…- i en quina freqüència o probabilitat.
Sorprenentment, Mendel va fer el gran descobriment fent experiments amb pesoleres als jardins del seu monestir acompanyat d’una interessant anàlisi estadística. Qui s’hauria imaginat que la solució a aquest problema passés per les matemàtiques?

Què es va descobrir?
Les troballes de Mendel i Morgan juntament amb Sutton i Boveri van iniciar la genètica actual. Van determinar que els caràcters són causats per uns gens que se segreguen independentment – tot i que ara sabem que no sempre – i que aquests gens són entitats físiques localitzades als cromosomes. A més, van descobrir que dins del cromosoma tenien una posició concreta.
Amb tot, ens van aclarir que no hi havia res místic en l’herència, tot es basa en una molècula, el DNA, tal com es va descobrir uns anys més tard. Finalment, el 1953 es va dilucidar la seva estructura en forma de la famosíssima i elegant doble hèlix.

Només ens falta aprendre a manipular-la…
Coneixíem que els caràcters vénen determinats pels gens. Sabíem que els gens eren seqüències de DNA amb unes característiques concretes. Els gens són els responsables –juntament amb l’ambient– de fer-nos com som nosaltres, el teu gat, les plantetes de la iaia i els bacteris i fongs que hi ha a la teva pell. I si aconseguíssim manipular-los?
Precisament això es va començar a fer a mitjans dels anys setanta amb el descobriment de les endonucleases, algunes de les quals coneixem com enzims de restricció. Aquestes endonucleases són unes proteïnes que actuen com a tisores, tallen el DNA en llocs concrets. També es van descobrir les lligases, unes altres proteïnes capaces d’enganxar fragments de DNA.
Ja podíem retallar i enganxar DNA de diferents espècies a voluntat. Havia nascut l’enginyeria genètica.
Evidentment la tasca no era gens fàcil
Les dificultats pràctiques d’aquestes tècniques d’enginyeria genètica eren grans, però tot i això es va aconseguir fer grans avenços que van posar sobre la taula idees que anys abans eren pura ciència-ficció. Ja al recent 2012, les científiques Charpentier i Doudna van desenvolupar una nova i revolucionària eina d’edició genètica, el famós CRISPR/Cas9. El CRISPR ha estat la gran promesa del segle, una eina capaç de modificar la regió de DNA que vulguem de l’ésser viu que vulguem d’una forma relativament senzilla.

Aquí sorgeixen noves implicacions bioètiques, legals, però també noves possibilitats
Com no es podia, ni s’havia d’evitar, va començar un debat ètic entorn de qüestions d’edició genètica que van des dels cultius transgènics fins a l’edició genètica de nadons. Així i tot, avui no plantejaré aquestes qüestions, sinó unes de ben diferents. Veurem com podem modificar el material genètic de poblacions senceres d’animals salvatges per resoldre diferents problemes.
Hem alterat profundament el nostre entorn
Com ja saps la constant i descontrolada explotació dels recursos naturals propis dels models de producció i consum actuals han creat la tempesta perfecta per a la desestabilització dels ecosistemes a escala global. Les tales de boscos i la seva substitució per conreus de monocultiu, l’extinció d’espècies, l’arribada d’espècies invasores, la destrucció d’hàbitats naturals i el canvi climàtic, en general, ens està portant a una situació ecològicament molt alarmant i insostenible.

Nosaltres mateixos som responsables de tots aquests problemes, i per això tenim l’obligació d’aturar-los i intentar-los revertir amb les eines que tinguem, com l’enginyeria genètica.
D’entre totes les conseqüències de la nostra activitat vull parlar-vos de les plagues d’espècies invasores i de les malalties transmeses per animals com els mosquits.
Els dos problemes tenen alguna cosa en comú
Si t’hi fixes, en ambdós casos tenim una població d’animals que causen un problema als humans en sí, o al propi ecosistema. Per exemple, la plaga de conills d’Austràlia que es remunta al segle XIX.
Aquests conills provoquen grans pèrdues de cultius i acceleren l’extinció d’altres espècies, com també ho fa la plaga de rates de Nova Zelanda. En aquest segon cas, sí que hi ha una amenaça directa per a les poblacions autòctones d’ocells que resulta molt preocupant.

Finalment, el més important, els mosquits transmissors de malalties són responsables d’unes 700.000 morts anuals, a més d’altres tipus de conseqüències, com les importants afectacions cognitives en persones que han superat la malària.
Noves tecnologies per afrontar aquests problemes: la genètica dirigida
Aquests problemes s’han resolt tradicionalment amb insecticides- en el cas dels mosquits- i amb trampes, verins i fins i tot caça en el cas dels conills i les rates. Aquests mecanismes tenen grans inconvenients com el guany d’una resistència contra els insecticides, una contaminació del medi ambient i efectes perjudicials sobre altres espècies.
Per aquests motius es presenta la genètica dirigida –gene drive en anglès-com a nova tecnologia per aconseguir erradicar o disminuir les poblacions d’aquestes plagues o vectors d’infeccions. La genètica dirigida és un fenomen natural dut a terme per elements genètics egoistes –selfish genetic elements-.
Bàsicament, aquests elements egoistes són seqüències de DNA que es transmeten a la descendència amb unes freqüències molt superior a les típiques, que coneixem com a mendelianes. Per exemple, com veiem a la imatge, un gen mendelià -”normal”- es transmetria a la meitat de la descendència. En canvi, un element egoista arribaria entre a un 80% i un 95% de la descendència.
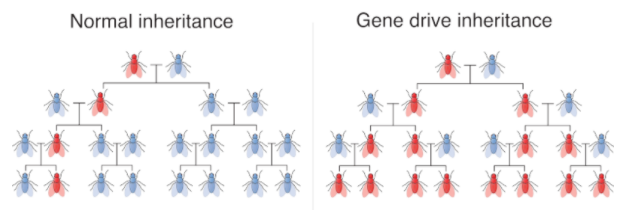
Quines conseqüències té això i per què ens pot servir?
En primera instància, l’ús de la genètica dirigida fa que un element genètic s’acabi expandint per tota la població molt ràpidament. D’aquesta forma podem fer que tots els animals d’una població acabin tenint el gen que ens interessa, o bé, que tots tinguin un gen que ens interessa desactivat.
Un mecanisme relativament senzill
Amb CRISPR hem pogut crear un mecanisme inspirat amb el funcionament dels elements genètics egoistes naturals, però més versàtil i específic. La genètica dirigida basada en CRISPR consisteix a introduir en un cromosoma un paquet de seqüències a partir de les quals es pot sintetitzar una maquinària. Aquesta maquinària són una guia per identificar la zona on volem tallar tall, unes tisores i opcionalment el gen que ens interessi expandir – que corresponen respectivament a un gRNA, Cas9 i un gen d’interès-.
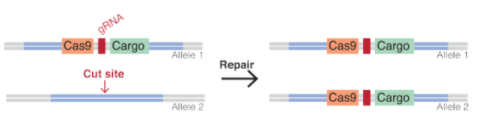
Aquesta construcció, com ja hem dit, genera aquesta maquinària que anirà al cromosoma homòleg on es copiarà sencera – si ho hem posat al cromosoma que ve de la mare, es copiarà al que ve del pare-.
I la descendència què?
Si fem que aquest mecanisme només s’activi als òrgans reproductors, és a dir, allà on es creen els espermatozoides i els òvuls – mitjançant promotors específics de teixit ovari i testicle- aconseguirem que pràcticament totes les cèl·lules sexuals tinguin el gen que volem.
Llavors, gairebé tota la descendència també el tindrà i així seguirà la propagació autònoma del gen.
El cas dels mosquits
Recordem que a moltes zones del món com a parts de l’Àfrica, Sud Amèrica i Àsia existeixen mosquits transmissors de malalties com el dengue, la malària, etc. Podríem eliminar-los alliberant una gran quantitat de mosquits modificats genèticament per introduir-los la genètica dirigida basada en CRISPR que ja hem explicat.
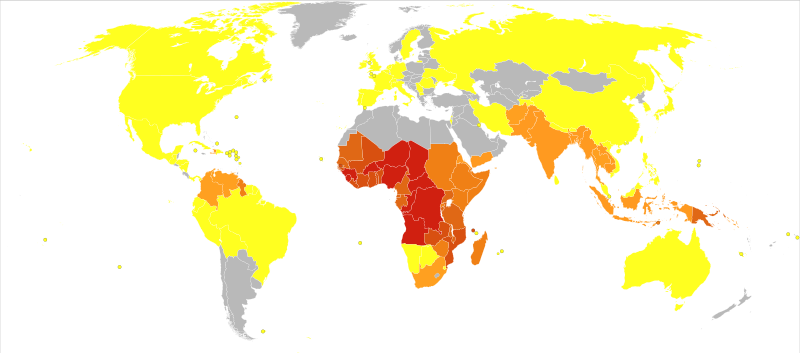
Així els mosquits del laboratori s’aparellarien amb els salvatges i amb poques generacions el gen introduït ja estaria en pràcticament tots els individus de la població.
En aquest cas específic ens interessa eliminar-los, llavors en comptes d’introduir un gen, podem fer que la maquinària actuï dins d’un gen important per la fertilitat de les femelles i l’inactivi. D’aquesta forma quan una femella no té cap gen funcional, és estèril.
En conclusió, amb algunes generacions arribarem a obtenir una població on la majoria de femelles són estèrils, fet que acabarà provocant un col·lapse o com a mínim una disminució de la població. Llavors hi hauria menys mosquits i molts menys casos de malària.
Ja per acabar…
Aquesta tecnologia ja s’ha provat amb mosquits, mosques i ratolins en les condicions controlades de laboratori, però ens enfrontem a una qüestió complicada per què tal i com diu el pioner científic del MIT, Kevin Esvelt:
Els riscos ecològics poden ser baixos, però el deteriorament de la confiança de la societat en la biotecnologia podria posar en perill el futur del camp
Per això, tal i com ell mateix proposa i fa, cal establir un llarg debat amb les persones d’aquelles zones on es vulgui posar en pràctica aquesta tecnologia.
Per saber-ne més
Cell Press – CRISPR-Based Gene Drives for Pest Control
MDPI – Gene Drive for Mosquito Control
Netflix – Selección antinatural