Aquest reportatge forma part de la col·lecció de reportatges sobre la vida extraterrestre. A l’anterior reportatge parlàvem sobre l’estructura de la vida… quin tema tractarà el proper?
Sovint es parla del planeta Terra com el “planeta blau”. Vist des de l’espai exterior, una gran part de la superfície té un to blavós a causa de la presència d’aigua líquida a la seva superfície. Altres planetes, com Urà i Neptú, també tenen tonalitats blaves, però per motius completament diferents. Avui entendrem la importància de l’aigua en el camí de la vida!
Comencem pels fonaments
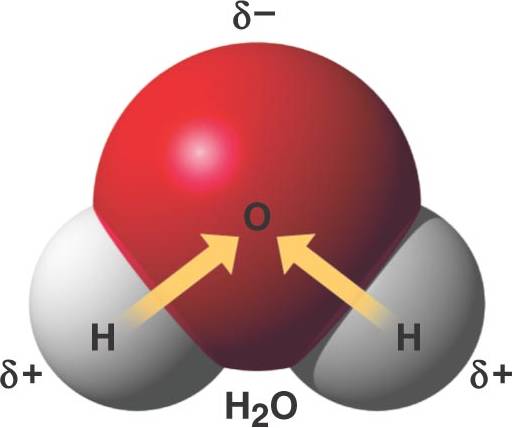
L’aigua, en el seu sentit més estricte, és una molècula. Aquesta molècula, com bé deus saber, està formada per dos àtoms d’hidrogen i un àtom d’oxigen, ordenats de la manera següent :

Aquesta simple estructura defineix totes les propietats que té l’aigua, i fan d’ella una molècula indispensable per la vida. En anteriors reportatges parlàvem de la importància dels enllaços entre diferents àtoms, i aquesta n’és la prova per excel·lència.
Desglossant la molècula
Si partim dels àtoms que formen l’aigua, en trobem de dos tipus diferents: hidrogen i oxigen. Aquests àtoms tenen propietats molt diferents entre si, però és la seva connexió i interacció la que aporta propietats úniques a la molècula d’aigua.
Per començar, cada àtom té un diferent nombre d’electrons disponibles per enllaçar-se. Aquests electrons es coneixen com la capa de valència. Mentre que els àtoms d’hidrogen només en tenen un, l’àtom d’oxigen en té sis. Aquests electrons es troben ordenats segons la seva energia, i l’objectiu d’un àtom és tenir la seva capa de valència completa.
En el cas de l’hidrogen, la capa de valència conté un electró, i el màxim d’electrons que pot acollir és de dos. En el cas de l’oxigen, la capa de valència conté sis electrons, i el màxim d’electrons que hi tenen cabuda son vuit. Aquests valors venen determinats per una sèrie de números i equacions, però això és una altra història…
Quina és, doncs, la solució més beneficiosa pels àtoms? Compartir! A la molècula d’aigua, els àtoms d’hidrogen comparteixen el seu electró amb l’àtom d’oxigen. Alhora, l’àtom d’oxigen comparteix un electró amb cada àtom d’hidrogen. D’aquesta manera, tots els àtoms aconsegueixen omplir la seva capa de valència i crear el que s’anomena un enllaç covalent.

Un enllaç prou especial
Doncs ja tenim la nostra molècula. Ja tenim clar com s’ha format l’enllaç i quina és la distribució dels àtoms i dels seus electrons. Ara bé, quines conseqüències arrossega aquesta estructura?
Per començar, ens fixarem de nou en la distribució electrònica de la molècula. Els tres àtoms son neutres: cap té més electrons que al principi. El parell d’electrons compartits formen part, alhora, de la distribució electrònica dels àtoms d’hidrogen i de l’àtom d’oxigen. Tot i això, tots els electrons de la molècula es veuen més atrets cap a l’oxigen, ja que té més protons al nucli.
Això provoca un enllaç covalent polar. És a dir, de la mateixa manera que un terminal elèctric té un pol positiu i un pol negatiu, la molècula d’aigua conté un àtom d’oxigen (negatiu) i dos àtoms d’hidrogen (positiu), i, per tant, podem dir que és polar, concretament, dipolar. Això no vol dir que l’aigua sigui una molècula carregada elèctricament, sinó que té una distribució de càrregues desigual en la molècula, no homogènia.
Igual busca igual
Aquesta simple ordenació de quelcom tan petit com els electrons comporta a una pila de conseqüències. Sense anar massa enllà, la setmana passada vam veure com la polaritat de l’aigua permetia crear el punt de neu en batre les clares de l’ou.
Totes les propietats moleculars que hem anat comentant fan que l’aigua sigui un bon dissolvent. En tenir un comportament dipolar, es poden crear interaccions entre l’aigua i les molècules veïnes polars per dissoldre-les i hidratar-les. Ho podem veure quan dissolem sal en aigua, ja que la sal està formada per ions amb càrrega. L’aigua, gràcies al seu potencial polar, pot separar aquests ions.
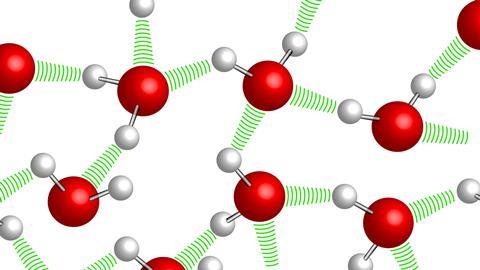
Aquestes interaccions que crea l’aigua amb les molècules polars del seu voltant s’anomenen ponts d’hidrogen. Per entendre’ns, podríem dir que tenir un enllaç covalent equival a dues persones agafant-se la mà, però un pont d’hidrogen seria mantenir contacte visual directe amb una tercera persona. Els àtoms de les diferents molècules, doncs, no estan lligats, però sí que hi ha una interacció feble entre ambdós.
Els ponts d’hidrogen funcionen de la mateixa manera que nosaltres coneixem les interaccions electroestàtiques: un pol positiu busca un de negatiu. Així, els àtoms d’hidrogen de l’aigua s’orienten per buscar pols negatius en altres molècules i els àtoms d’oxigen s’orienten per buscar pols positius en altres molècules. Força intuïtiu, oi?

L’estat de l’aigua: el primer pas per la vida
Aquests ponts d’hidrogen són responsables de les interaccions de l’aigua amb diferents molècules… que poden ser també d’aigua! Per definir els principals estats de la matèria –sòlid, líquid o gas–, un dels criteris a seguir és quina interacció té una substància amb ella mateixa.
En el cas de l’aigua, els ponts d’hidrogen determinen en gran manera el seu estat. Si hi ha baixa temperatura, les molècules es mouen poc i poden arribar a formar fins a 9 ponts d’hidrogen cadascuna! Això aporta una gran força de cohesió i estabilitat, una xarxa cristal·lina que anomenem gel.
En altres casos, com a temperatura ambient, l’aigua pot fer una estructura regular de tres a quatre ponts d’hidrogen entre molècules. En el cas d’altes temperatures, la connexió entre molècules és més dèbil, i és formada per un menor nombre de ponts d’hidrogen, per la qual cosa trobarem vapor d’aigua.
I això, per què és tan important? La vida va aparèixer a l’aigua, i la majoria de reaccions químiques essencials per la vida ocorren en un medi aquós. Per aquesta raó, era essencial que l’aigua perdurés en el temps perquè la vida pogués obrir-se pas i crear totes les estructures necessàries.
Tot gràcies al gel
Segurament, en algun moment de la teva vida, has posat gels en una glaçonera o has comès l’error de posar una llauna plena de líquid al congelador. Què ha passat en ambdós casos? Que el volum del líquid ha augmentat en passar a estat sòlid. L’ordenació de les molècules provoca, en aquest cas, un augment de volum. Si tenim la mateixa massa d’aigua, però en un volum superior, podem dir que el gel té una densitat inferior a l’aigua líquida.
Això és summament important, i a la natura ho podem veure en els icebergs o el gel permanent de l’oceà Àrtic. En congelar-se, el gel sura, i se situa per sobre de l’aigua líquida. Si el gel tingués una densitat superior a l’aigua líquida, s’enfonsaria, i l’aigua de la superfície s’aniria congelant fins a convertir-se en gel. Aquest fet provoca que les capes de gel protegeixin l’aigua líquida del mar de l’exposició a les temperatures més baixes, permetent així la continuïtat i el desenvolupament de la vida sota sota la superfície.
Us presentem… el LUCA!
Encara que no es conegui exactament el primer ésser viu de la Terra, ens podem remuntar al primer del qual en tenim constància. Aquest es coneix com a LUCA, les inicials de l’Últim Ancestre Universal Comú (Last Universal Common Ancestor). Gràcies a l’anàlisi de seqüències de DNA, podem estimar que el LUCA vivia en xemeneies hidrotermals al fons de l’oceà, i és per això que podem dir, amb força seguretat, que la vida va sorgir a l’aigua.
Per aquesta raó, en la recerca d’hàbitats fora del planeta Terra, la presència d’aigua en qualsevol dels seus estats és un gran indicador per trobar un lloc habitable per la humanitat. Per exemple, el lloc d’aterratge del robot Perseverance a la superfície de Mart no és casual: se sospita que l’actual cràter Jezero va ser, en el seu moment, un delta fluvial inundat d’aigua.
Ja per acabar…
Tot i que l’aigua és un molt bon indicador per determinar la possibilitat de vida extraterrestre, hi ha una pila de biomolècules inorgàniques que també són molt útils! La tardor passada, per exemple, vam seguir de prop les investigacions al voltant de la detecció de fosfina a l’atmosfera de Venus. Al final, va resultar ser un error de calibratge, així que només ens queda… seguir buscant!
Per saber-ne més
World of Molecules – Why do solids, liquids and gases behave so differently?
ESALQ – Hydrogen Bonding in Water
NASA Mars – Jezero Crater